Đặt vấn đề
AHPND (Bệnh hoại tử gan tụy cấp) hay EMS (Hội chứng chết sớm) trên tôm nuôi lần đầu tiên được phát hiện tại Trung Quốc năm 2009 (nhưng tại thời điểm đó chưa được quan tâm). Đầu năm 2011, bệnh bùng phát và trở nên nghiêm trọng, 80% sản lượng tôm bị chết tại các tỉnh Hải Nam, Quảng Đông, Phúc Kiến và Quảng Tây, Trung Quốc (Leaío & Mohan, 2012). Dịch bệnh xuất hiện và bùng phát trên TTCT được nuôi ở Việt Nam năm 2010, ở Malaysia năm 2011, ở Thái Lan năm 2012 và 2013 và ở Philippines năm 2013 và 2014. Ước tính thiệt hại trực tiếp và gián tiếp do AHPND gây ra cho ngành nuôi tôm của khu vực châu Á lên tới 1 tỷ USD (FAO, 2013).
Đặc điểm của bệnh AHPND là lây lan rất nhanh, tỷ lệ chết cao (có thể lên tới 100%), thường trong vòng 30 - 35 ngày thả ao nuôi với tôm post hoặc tôm nhỏ. Bệnh do thể thực khuẩn của vi khuẩn Vibrio parahaemolyticus gây ra, chúng đi qua đường miệng và xâm nhập vào đường tiêu hóa của tôm, sau đó tạo ra độc tố phá hủy cấu trúc và chức năng cơ quan tiêu hóa của tôm là gan tụy. Do đó, việc đánh giá thử nghiệm này rất cần thiết nhằm xác định khả năng chống lại vi khuẩn Vibrio parahaemolyticus.
Pondguard, chế phẩm do nhóm nghiên cứu thuộc PT Asclepius Pharmaceutical Sciences Indonesia, Indonesia nghiên cứu sản xuất và cung cấp cho thử nghiệm này. Đây là một hỗn hợp các tinh dầu chiết xuất từ thiên nhiên như tinh dầu oải hương, tinh dầu khuynh diệp, tinh dầu thông giúp duy trì khả năng miễn dịch của tôm, giúp bảo vệ tôm khỏi các bệnh truyền nhiễm. Sản phẩm Pondguard đã được cấp phép bởi Bộ Thủy sản Indonesia, số đăng ký D 16060285 - HBC. Sản phẩm ở dạng lỏng, hòa tan tốt trong nước, không màu và có pH 6,8 - 7,4 (Jha và ctv, 2016).
Phương pháp thí nghiệm
TTCT dùng cho thí nghiêm này có khối lượng trung bình 0,6 - 0,8 g/con (đây là kích cỡ tôm dễ bị tấn công bởi vi khuẩn Vibrio parahaemolyticus). Tôm thí nghiệm đã được sàng lọc bằng Real time PCR các tác nhân gây bệnh đốm trắng, AHPND và vi bào tử trùng gây bệnh tại Chi cục Thú y vùng II vào tháng 12/2019.
Tác nhân gây bệnh là Vibrio parahaemolyticus (VP) - chủng gây bệnh AHPND được sử dụng trong thí nghiệm là VP36, được phân lập từ tôm bị nhiễm AHPND (chủng đã được phân lập từ tôm bệnh lấy ở Sóc Trăng vào tháng 9/2016). Chủng VP36 được bảo quản ở - 800C trong môi trường. Vi khuẩn được xác nhận là VP khi cho khuẩn lạc màu xanh trên môi trường TCBS agar (Thiosulfate Citrate Bile Salts Sucrose Agar) và khuẩn lạc màu tím trên môi trường CAV (Chrom Agar Vibrio), dương tính khi kiểm tra bằng phương pháp PCR với mồi AP3 (Sirikharin và ctv, 2014).
Tôm thí nghiệm được cho ăn 3 lần một ngày vào 8h, 12h30 và 17h hàng ngày. Bể nuôi, hệ thống sục khí và sản phẩm Pondguard được sử dụng theo liều lượng hướng dẫn của nhà sản xuất.
Thiết kế thí nghiệm
Chuẩn bị bể thí nghiệm bằng thủy tinh. Mỗi bể chứa 30 lít nước biển (nồng độ 15‰), có hệ thống sục khí liên tục và duy trì nhiệt độ nước từ 28 - 300C. Nhóm thí nghiệm và nhóm đối chứng được bố trí trong hai phòng riêng biệt, khoảng cách giữa hai phòng khoảng 15 m. Tôm được thả với mật độ 15 - 20 con/bể.
Hoạt hóa vi khuẩn VP36 trên môi trường CAV, vi khuẩn được nuôi cấy trong môi trường TSB+ trong 18 giờ, ở nhiệt độ 280C.
Sản phẩm Pondguard được cho vào trong bước nuôi cấy vi khuẩn. Có hai nhóm thí nghiệm: Thí nghiệm 1, sản phẩm được cho trực tiếp sau khi cấy vi khuẩn và nuôi lắc trong 18 tiếng. Nhóm 2, sau 18 giờ nuôi lắc vi khuẩn, sản phẩm được cho vào môi trường và giữ tiếp trong 3 giờ trước khi tiến hành cho lây nhiễm. Dùng hộp nhựa chứa khoảng 300 ml dung dịch gồm nước biển và 30 ml môi trường vi khuẩn TSB+, có sục khí liên tục, ngâm 15 - 20 con tôm trong 15 phút. Sau đó, chuyển tất cả vào bể nuôi có chứa nước biển, giảm mật độ vi khuẩn xuống 106 tế bào/ml.
Tỷ lệ thức ăn là 7% trọng lượng tôm, cho ăn 3 lần/ngày trong suốt thời gian tiến hành thử nghiệm. Trong vòng 48 giờ sau khi cho lây nhiễm sẽ không thay nước, sau đó sẽ thay 20% nước trong bể mỗi ngày. Quan sát lượng tôm chết vào cùng thời gian cho tôm ăn. VP tổng số trong nước được đếm bằng cách đếm khuẩn lạc trên môi trường TCBS. Mẫu nước được lấy hàng ngày sau khi thay nước. Mẫu nước được lấy ở 3 bể trong mỗi nhóm. VP tổng số trên tôm được đếm bằng phương pháp RT-PCR. Mẫu tôm (tôm sống) được lấy vào lúc 0 giờ (trước khi tiến hành lây nhiễm) và lấy 2 ngày/lần.
Kết quả
Trong nhóm thí nghiệm 1, Pondguard được cho vào môi trường nuôi TSB+ với tỷ lệ 0,2% canh trường cùng lúc với cấy vi khuẩn, nuôi trong vòng 18 giờ. Trong thí nghiệm 2, Pondguard được cho với tỷ lệ 0,3% canh trường, cho vào sau khi vi khuẩn đã được nuôi 18 giờ.

Hình 1: Tỷ lệ tôm chết cộng dồn sau 8 ngày gây nhiễm
Mật độ của vi khuẩn trong nhóm đối chứng dương sau 18 giờ nuôi cấy là 9,4x108 cfu/ml, lượng vi khuẩn phát triển đã được phát hiện trong hai nhóm.
Không có trường hợp tôm chết nào được ghi nhận trong nhóm thí nghiệm dùng sản phẩm Pondguard. Trong nhóm đối chứng dương, tỷ lệ chết là 45% vào ngày thứ 8 sau khi gây nhiễm. Không có tôm chết trong nhóm đối chứng âm.
Trong nhóm đối chứng dương, tôm bắt đầu chết sau 12 giờ gây nhiễm. Nhóm đối chứng âm và nhóm thí nghiệm không có tôm chết.
Các dấu hiệu biểu hiện trên tôm bị nhiễm bệnh AHPND rất điển hình, như: dạ dày và ruột rỗng, gan tụy nhợt nhạt. Không quan sát được các dấu hiệu điển hình đó trong nhóm thí nghiệm 1. Trong nhóm thí nghiệm 2, các dấu hiệu bệnh AHPND xuất hiện trong ngày đầu tiên cho lây nhiễm với tỷ lệ 6,7%. Trong nhóm thí nghiệm 2, tôm dần phục hồi theo từng ngày và hoàn toàn bình thường vào ngày thứ 8 sau khi cho lây nhiễm; các dấu hiệu nhiễm bệnh đạt tỷ lệ tối đa 100% trong ngày đầu tiên gây nhiễm. Không có dấu hiệu nhiễm bệnh AHPND ở nhóm đối chứng âm.
Khả năng tiêu thụ thức ăn cũng được sử dụng là chỉ số để đánh giá về tình trạng sức khỏe cũng như mức độ stress của tôm. Trong nhóm thí nghiệm 1, tôm duy trì tiêu thụ thức ăn ở mức tối đa. Trong nhóm thí nghiệm 2 có sự giảm nhẹ về việc tiêu thụ thức ăn xảy ra đồng thời với việc xuất hiện các dấu hiệu bệnh AHPND. Việc tiêu thụ thức ăn trong nhóm đối chứng dương giảm mạnh. Điều này cho thấy trong nhóm thí nghiệm có dùng sản phẩm Pondguard, tôm không xuất hiện bệnh AHPND.
Phân tích RT - PCR: Phản ứng RT - PCR được thực hiện để phân tích mẫu gộp (dạ dày, gan tụy và ruột được cắt nhỏ lẫn với nhau). Nhóm đối chứng dương có giá trị Ct (Threshold cycle) thấp có nghĩa là số lượng mầm bệnh có mặt cao. Sự có mặt của mầm bệnh thấp đồng nghĩa với giá trị Ct cao, trong ngày đầu tiên và ngày thứ 3 của nhóm thí nghiệm 1. Tôm trong nhóm thí nghiệm được phục hồi sau 3 ngày và tất cả các mẫu sau đó đều cho kết quả âm tính với AHPND.
Tổng số khuẩn lạc Vibrio màu xanh từ mẫu tôm: Gan tụy, dạ dày và ruột được lấy và nghiền lẫn từ mẫu tôm sống. Mẫu lấy từ nhóm đối chứng dương có số khuẩn lạc xanh cao nhất. Tôm trong nhóm thí nghiệm có số khuẩn lạc thấp hơn 103 - 102 lần, đây là con số được coi là ở mức độ không nhiễm bệnh.

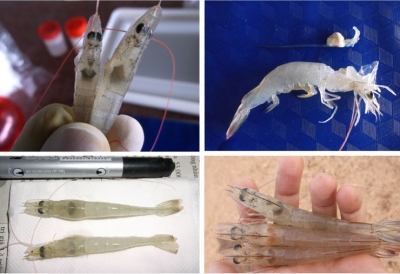
Hình 2: Từ trái qua phải: đối chứng âm, đối chứng dương, thí nghiệm 1 và thí nghiệm 2. Các dấu hiệu đặc trưng của AHPND gồm ruột rỗng, gan tụy nhợt nhạt được thấy rõ trong nhóm đối chứng dương.
Mẫu nước được lấy hàng ngày trong suốt thời gian thí nghiệm để kiểm tra lượng Vibrio tổng số có trong môi trường nuôi tôm, cấy trên môi trường TCBS và đếm khuẩn lạc sau 20 giờ.
Kết quả cho thấy tổng số khuẩn lạc VP trong mẫu nước của nhóm đối chứng dương cao hơn so với các nhóm khác.
Kết luận
Chủng VP gây chết trên tôm với các biểu hiện đặc trưng của AHPND. Pondguard có khả năng kìm hãm sự phát triển của VP trên tôm, vì vậy mà không có tôm bị chết và cũng không có các đặc điểm của AHPND xuất hiện trên tôm. Trong nhóm thí nghiệm sử dụng sản phẩm Pondguard, kết quả RT-PCR âm tính cho thấy sự phát triển của VP đã bị ức chế hoàn toàn. Pondguard có khả năng tiêu diệt vi khuẩn VP trong nước nuôi tôm.
Theo:thuysanvietnam.com.vn


.png)











.jpg)


